Wie Heiß Ist Eine Blaue Flamme
Flammenfärbung einfach erklärt
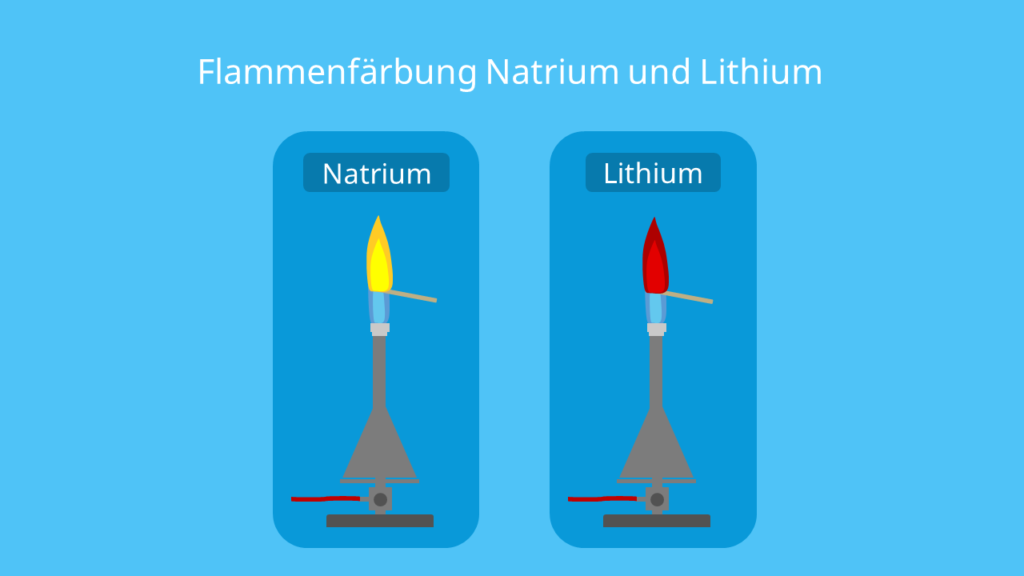
Bei der Flammenfärbung, in der Chemie auch Flammenprobe genannt, verfärbt sich eine Flamme. Meistens handelt es sich um dice blaue Flamme eines Bunsenbrenners. Je nachdem, welches chemische Element in die Nähe der Flamme kommt, nimmt sie eine andere Farbe an. Beispielsweise sorgt Natrium (Na) dafür, dass sich dice Flammenfarbe von blau zu gelb ändert. Lithium (Li) hingegen färbt die Flamme rot.
Merke: Nicht nur dice Elemente, sondern auch die meisten ihrer Salze (Natriumchlorid NaCl, Lithiumchlorid LiCl) verfärben dice Flamme.
Dadurch kannst du verschiedene Elemente (bzw. deren Ionen ) nachweisen. Aber warum verfärbt sich die Flamme? Das liegt daran, dass dice Elemente Licht aussenden.
Flammenfarben
Wie sieht eigentlich die Durchführung einer Flammenfärbung aus? Beim typischen Versuch musst du zunächst deine zu untersuchende Probe klein mörsern. Dann gibst du einige Tropfen Salzsäure (HCl) hinzu. Durch dice Säure bilden sich nämlich Chloride (Natriumchlorid NaCl, Lithiumchlorid LiCl), dice besonders leicht verdampfen.
Anschließend gibst du deine Probe auf ein Magnesiastäbchen und hältst es in eine Bunsenbrennerflamme. Anhand der Färbung wirst du dann erkennen, welches Element in deiner zu untersuchenden Substanz vorhanden ist.
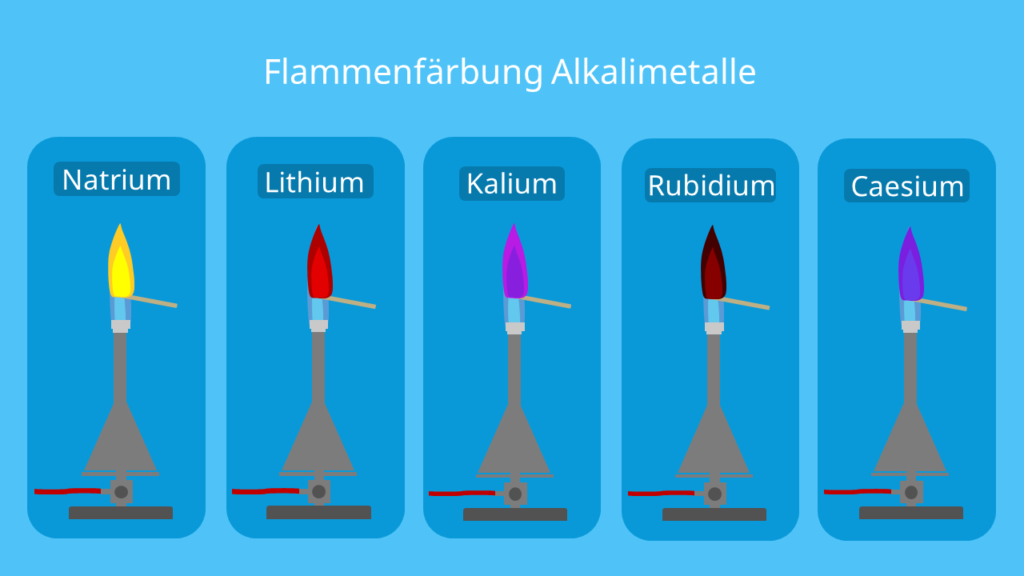
Flammenfärbung Alkalimetalle
In der folgenden Tabelle kannst du sehen, wie unterschiedliche Alkalimetalle die blaue Flamme des Bunsenbrenners färben:
| Alkalimetall | Flammenfärbung |
| Natrium (Na) | Die Flamme ändert ihre Farbe zu gelb. |
| Lithium (Li) | Die Lithium-Flamme erscheint rot. |
| Kalium (Chiliad) | Du siehst eine violette Flamme. |
| Rubidium (Rb) | Eine rote Flamme wird sichtbar. |
| Caesium (Cs) | Du erkennst eine blau violette Färbung. |
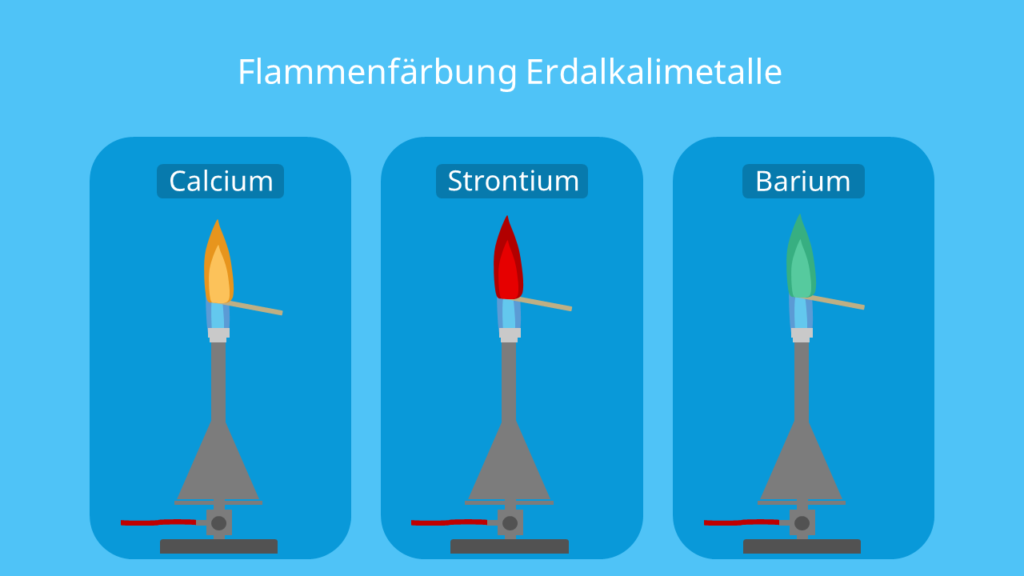
Flammenfärbung Erdalkalimetalle
Auch die Erdalkalimetalle rufen unterschiedliche Färbungen bei der Brennerflamme hervor:
| Erdalkalimetall | Flammenfärbung |
| Calcium (Ca) | Die Flamme erscheint orange–rot. |
| Strontium (Sr) | Hier siehst du dann eine rote Flamme. |
| Barium (Ba) | Barium sorgt für eine grüne Flamme. |
Auch Magnesium (Mg) gehört zu den Erdalkalimetallen. Aber wie sieht dice Flammenfärbung von Magnesium aus? Tatsächlich verfärbt das Metall die Flamme gar nicht.
Unterscheidung von Flammenfärbungen
Mehrere Metalle sorgen für eine rote Flamme. Woher weißt du dann, um welches Metall es sich in deiner Probe handelt? Dafür kannst du dir ein Spektroskop zur Hand nehmen. Wenn du durch ein solches Spektroskop schaust, kannst du bestimmte Linien (Wellenlängen der Farbe) sehen:
- Lithium: Befindet sich Lithium in deiner Probe, erscheinen die Linien im Bereich von 671 nm (Nanometern).
- Rubidium: Bei Rubidium siehst du dice Linien entweder bei 780 nm oder bei 421 nm.
- Strontium: Auch bei Strontium gibt es zwei charakteristische Linien und zwar bei 675 nm und bei 606 nm.
Du kannst die Rottöne mit bloßem Auge also nicht unterscheiden, mit dem Spektroskop wird es aber möglich.
Flammenfärbung: Kobaltglas
Es kann sein, dass die gelbe Flamme von Natrium andere Färbungen überschattet. Das führt dann dazu, dass du möglicherweise nicht alle Metalle, die sich in deiner Probe befinden, identifizieren kannst. Um dem entgegenzuwirken, kannst du dir bei der Flammenfärbung ein blaues Kobaltglas zur Hilfe nehmen. Das Glas filtert nämlich dice Gelbanteile im Licht heraus, wodurch andere Farben wieder besser zu erkennen sind.
Aber Achtung : Durch das Kobaltglas erscheinen die charakteristischen Farben der Elemente etwas anders als ohne:
| ohne Kobaltglas | mit Kobaltglas | |
| Lithium (Li) | rot | violett |
| Kalium (G) | violett | orangish |
| Calcium (Ca) | orange –rot | hellgrün |
| Strontium (Sr) | rot | violett |
| Barium (Ba) | grün | blaugrün |
Flammenfärbung Erklärung
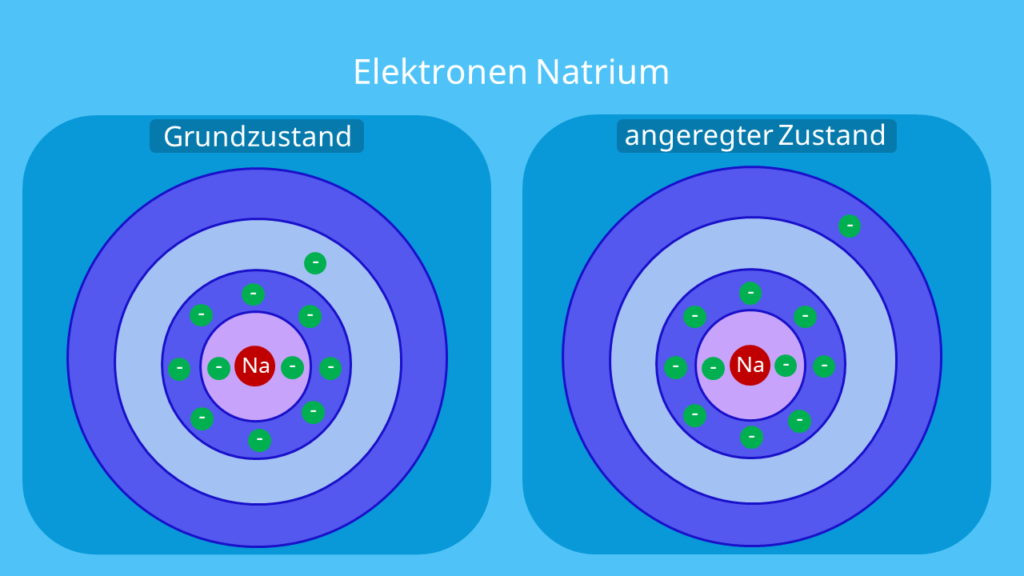
Aber wie kommt es überhaupt zu einer Verfärbung der Bunsenbrennerflamme? Die Elemente, dice zu einer Flammenfärbung fähig sind, senden bei der Flammen-Temperatur (etwa 1100°C) Licht aus. Schauen wir uns das Ganze am besten anhand von Natrium (Na) an.
In einem Natriumatom befinden sich mehrere Elektronen auf unterschiedlichen Schalen . Durch dice Flamme erfahren die Natriumatome eine Temperaturerhöhung. Damit können sich die Elektronen bewegen und auf eine höhere Schale angehoben werden. Das nennst du dann den angeregten Zustand. Allerdings hält der Zustand meistens nicht lange an, sodass die Elektronen wieder in ihre ursprüngliche Schale ‚zurückfallen' . Das ist der Grundzustand. Bei dem Vorgang wird Energie frei. Das wird dann in Course von Photonen, too Licht, abgegeben.
Moderne Technik
Bei der Flammenfärbung musst du also mit deinen Augen erkennen, um welches Metall es sich handelt. Mittlerweile gibt es aber genauere Methoden, um festzustellen, was genau sich in deiner Probe befindet. Eine bekannte Vorgehensweise ist die Atomspektroskopie. Mithilfe der Atomspektroskopie kannst du nicht nur die Art, sondern auch die Menge des Metalls in deiner Probe herausfinden. Anhand der charakteristischen Linien kannst du die Elemente identifizieren. Die Intensität (Helligkeit) der Linien sagt dir, wie viel von deinem Element in der Probe ist.
Aber wie genau funktioniert das mit den charakteristischen Linien? Das erklären wir dir in unserem Video zur Spektralanalyse. Schau also direkt vorbei!
Source: https://studyflix.de/chemie/flammenfarbung-3407


0 Response to "Wie Heiß Ist Eine Blaue Flamme"
Post a Comment